PERSONALISIERTE MEDIZIN. Die mRNA-Impfung gegen Krebs steht in den Startlöchern – ein Meilenstein für die individuelle Behandlung von Patient*innen. Über Wirkungsweise, Vorteile und Potenziale gibt Prof. Dr. Theo Dingermann Auskunft.
Text: Greta Lun | Foto: Bild generiert mit Adobe Firefly | Dingermann: privat

Prof. Dr. Theo Dingermann ist Apotheker und emeritierter Professor für Pharmazeutische Biologie an der Johann Wolfgang Goethe-Universität Frankfurt am Main.
Im Gegensatz zu einer Impfung gegen eine Infektionserkrankung ist die mRNA-Impfung gegen Krebs keine präventive, sondern eine therapeutische Maßnahme. Was passiert im Körper?
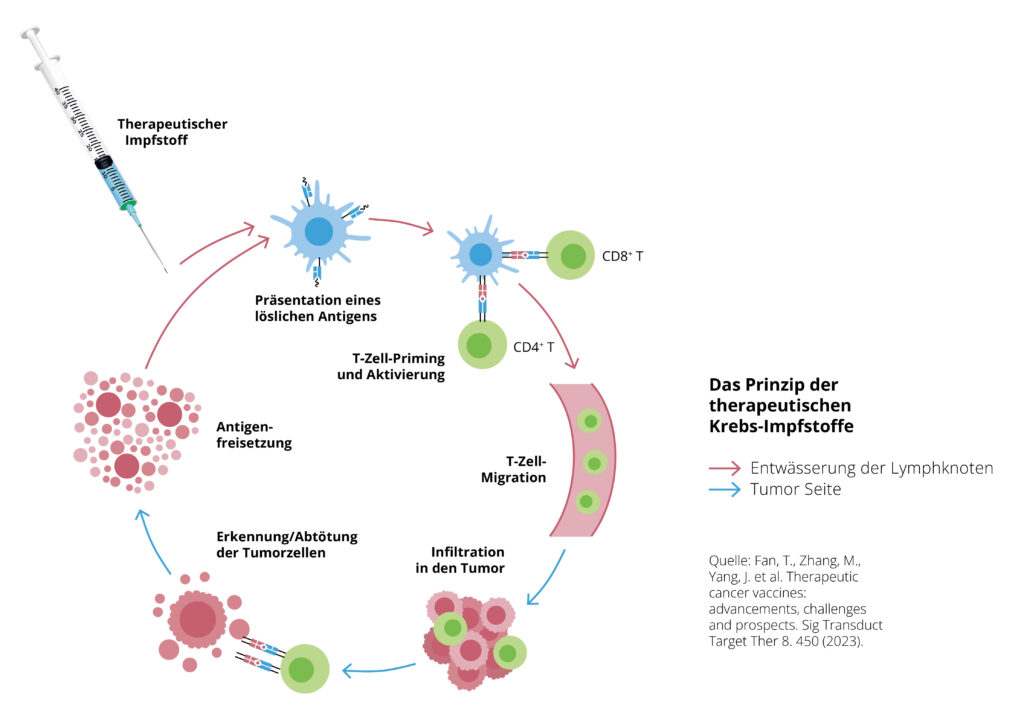
DINGERMANN: Bislang gab es so gut wie keine therapeutischen Impfungen – das ist also wirklich etwas Neues! Hier geht es darum, den Tumor durch das eigene Immunsystem zu zerstören. Der große Vorteil von mRNA-Impfstoffen ist, dass der Körper das Biomolekül, das das Immunsystem aktiviert, selbst herstellt. Ich verabreiche kein Antigen, sondern lediglich den Bauplan dafür. Die Immunzellen, die hier eine besondere Rolle spielen, sind die sogenannten zytotoxischen T-Zellen. Sie greifen die Tumorzellen an und zerstören sie.
Auch bei der Chemotherapie wird auf Zellzerstörung von schnell wachsenden Zellen gesetzt, weshalb den Behandelten oft die Haare ausfallen. Wirken diese T-Zellen dann zielgerichteter auf den Tumor?
DINGERMANN: Absolut! Die Chemotherapie ist ja überhaupt nicht zielgerichtet, sondern greift alle Zellen an, die sich rasch erneuern, also Tumorzellen genauso wie Haar- oder Darmzellen. Das verursacht Durchfall, Übelkeit und andere Nebenwirkungen. Eine Immuntherapie hat hingegen immer ein klares Ziel.
Könnten mRNA-Impfungen die Chemotherapie ersetzen?
DINGERMANN: Das kann ich mir nicht vorstellen. Als Molekularbiologe schaue ich auf die archaischen Methoden auch nicht herab – im Gegenteil. Will man dem Immunsystem eine Chance geben, braucht es oft eine bestimmte Vorbereitung. Auch heute wird vor einer chirurgischen Tumorentfernung oft eine Chemotherapie gemacht, um den Krebs zu schrumpfen. Das kann vor einer mRNA-Impfung auch sinnvoll sein, denn man will dem Immunsystem nicht so einen Riesenbrocken hinlegen, an dem es sich abarbeiten muss. Für diesen Zweck werden Chemotherapien nach wie vor mit großer Sicherheit eingesetzt.
mRNA-Impfungen sind vielen Menschen seit der Coronazeit geläufig. Tatsächlich werden diese Präparate schon seit vielen Jahren erforscht.
DINGERMANN: Ja, die Covid-Impfung resultiert aus den Forschungen, die lange vor der Pandemie begonnen haben. Die beiden Firmen BioNTech und Moderna haben an mRNA-Impfstoffen für die Krebstherapie geforscht und konnten das Prinzip für Covid-19 nutzen. Der große Vorteil ist die relativ rasche Herstellung. Ein Antigen muss hingegen isoliert, gereinigt und in großen Mengen produziert werden. Bei mRNA-Mitteln geht das wesentlich einfacher und günstiger.
Wie weit ist die mRNA-Impfung gegen Krebs fortgeschritten?
DINGERMANN: Klinische Studien an Menschen laufen schon lange. Erst waren sie noch wenig erfolgversprechend, weil man zu naiv an die Sache herangegangen ist: Ich isoliere den Tumor chirurgisch, hole mir die genetische Information durch Sequenzieren, vergleiche, worin sich das Genom des Tumors von jenem der normalen Zelle unterscheidet, und stelle ein entsprechendes Antigen her. Der Schlüssel zum Erfolg waren dann erst die Mechanismen, wie diese Antigene dem Immunsystem gezeigt werden. Denn Antikörper erkennen Antigene auf Zelloberflächen, die sogenannten Oberflächenantigene. Essenziell sind in diesem Zusammenhang die MHC-Moleküle (Major Histocompatibility Complex)
oder HLA-Moleküle (Humane Leukozyten Antigene), die von Mensch zu Mensch sehr unterschiedlich sind. Sie spielen übrigens auch bei Transplantationen eine wichtige Rolle, denn sie zeigen an, wie kompatibel ein Spenderorgan ist.
Trotzdem erhalten Menschen nach Transplantationen Immunsuppressiva, damit ihr Immunsystem das Fremdorgan nicht sofort abstößt.
DINGERMANN: Ja, weil es – bis auf eineiige Zwillinge – auf der Welt keine zwei Menschen mit dem gleichen HLA-System gibt. Übereinstimmende HLA Merkmale sind ein wesentlicher Faktor für die Gewebeverträglichkeit bei einer Organtransplantation.
Sind mRNA-Impfungen gegen Krebs bei immungeschwächten Menschen unwirksam?
DINGERMANN: Das kann sein! Damit dieser Ansatz überhaupt funktionieren kann, ist ein einigermaßen gutes Immunsystem erforderlich.
Für welche Tumore ist die mRNA-Impfung besonders geeignet?
DINGERMANN: Für alle, die viele Mutationen aufweisen. Denn dadurch unterscheidet sich der Tumor vom restlichen Gewebe. Ein mRNAImpfstoff kann bis zu 20 verschiedene Abschnitte aufweisen, die jeweils für ein unterschiedliches Antigen kodieren. Zeigt ein Tumor hingegen nur zwei geeignete Mutationen oder können die wenigen Antigene über die Oberflächenantigene gar nicht präsentiert werden, bringt eine Impfung nichts. Wir sind hier mitten in der personalisierten Medizin. Diese Impfstoffe werden nicht für das Regal gemacht, sondern individuell für einen bestimmten Menschen.
mRNA-Präparate sind im Vergleich zu Protein-Präparaten günstig herzustellen. Könnte das die Kosten fürs Gesundheitssystem senken?
DINGERMANN: Nur theoretisch, weil unser Gesundheitssystem nicht auf der Basis von Materialaufwand funktioniert. Die Pharmafirmen sind gezwungen, in dem kurzen Zeitraum, in dem ihre Substanz patentgeschützt ist, einen Return of Investment zu erzielen. Alle neuen Präparate sind absurd teuer, weil sie danach, wenn der Wettbewerb einsetzt, absurd billig werden.
Wer wird diese Impfstoffe bekommen?
DINGERMANN: Das ist natürlich eine ethische Frage. Die, die sich das leisten können oder gute Beziehungen haben? Der Anspruch muss sein: Alle, die davon profitieren können! Dass wir dafür die Möglichkeiten schaffen, halte ich für realistisch. Denn im Gegensatz zu den Proteinpräparaten ist der Aufwand für die Analysen und die Produktion von mRNA-Impfstoffen relativ gering, weil Apparaturen vieles vollautomatisch erledigen. Im Grunde braucht es für diese Krebs-Impfstoffe das gleiche Labor-Equipment wie für die mRNA-Corona-Impfstoffe. Auch in Entwicklungsländern kann die nötige Infrastruktur aufgebaut werden, so wie BioNTech es während der Corona-Pandemie zum Beispiel in Zentralafrika gemacht hat. Darauf können wir jetzt aufbauen. Jedenfalls können wir diese Technologie den Menschen, die sie brauchen, nicht vorenthalten.